中國(guó)化妝品備案注冊(cè)法規(guī)操作指南
背景介紹
2020年6月29日,中國(guó)國(guó)務(wù)院正式頒布《化妝品監(jiān)督管理?xiàng)l例》(Cosmetics Supervision and Administration Regulation, CSAR,國(guó)令第727號(hào)),并于2021年1月1日正式實(shí)施。這一法規(guī)的出臺(tái)標(biāo)志著中國(guó)化妝品監(jiān)管體系邁入全新的發(fā)展階段,確立了以安全性和科學(xué)監(jiān)管為核心的現(xiàn)代化管理體系。
作為中國(guó)化妝品行業(yè)的核心法規(guī),CSAR 在產(chǎn)品分類、注冊(cè)備案要求、生產(chǎn)經(jīng)營(yíng)管理、原料管理、功效宣稱、標(biāo)簽標(biāo)識(shí)、監(jiān)督檢查及法律責(zé)任等方面進(jìn)行了全面而系統(tǒng)的改革。新法規(guī)強(qiáng)化了企業(yè)主體責(zé)任,要求化妝品注冊(cè)人、備案人及生產(chǎn)企業(yè)建立健全的產(chǎn)品質(zhì)量和安全管理體系,確保產(chǎn)品的安全性和合規(guī)性。此外,CSAR 引入了風(fēng)險(xiǎn)管理原則、原料安全評(píng)估制度,并對(duì)產(chǎn)品功效宣稱提出了更加嚴(yán)格的科學(xué)驗(yàn)證要求,以提升消費(fèi)者權(quán)益保護(hù)水平。
在 CSAR 框架下,中國(guó)國(guó)家藥品監(jiān)督管理局(NMPA)陸續(xù)發(fā)布了一系列配套法規(guī)和技術(shù)規(guī)范,包括《化妝品分類規(guī)則和分類目錄》《化妝品注冊(cè)備案管理辦法》《化妝品標(biāo)簽管理辦法》《化妝品功效宣稱評(píng)價(jià)規(guī)范》《化妝品注冊(cè)備案資料管理規(guī)定》等,進(jìn)一步細(xì)化了監(jiān)管要求,確保法規(guī)的有效落地實(shí)施。這些法規(guī)的出臺(tái)不僅提高了化妝品行業(yè)的準(zhǔn)入門檻,也推動(dòng)了行業(yè)向更加科學(xué)化、透明化和國(guó)際化的方向發(fā)展。
本指南旨在幫助化妝品企業(yè)全面理解并嚴(yán)格遵循 CSAR 及其配套法規(guī)的要求,確保產(chǎn)品在中國(guó)市場(chǎng)的合規(guī)性與安全性,同時(shí)降低合規(guī)風(fēng)險(xiǎn),提升市場(chǎng)競(jìng)爭(zhēng)力,推動(dòng)行業(yè)健康、可持續(xù)發(fā)展。
化妝品定義
“化妝品,是指以涂擦、噴灑或者其他類似方式,涂抹于皮膚、毛發(fā)、指甲、口唇等人體表面,以清潔、保護(hù)、美化、修飾為目的的日用化學(xué)工業(yè)產(chǎn)品。”(《化妝品監(jiān)督管理?xiàng)l例》第一章第三條)
化妝品分類
化妝品分為特殊化妝品和普通化妝品。國(guó)家對(duì)特殊化妝品實(shí)行注冊(cè)管理,對(duì)普通化妝品實(shí)行備案管理。(《化妝品監(jiān)督管理?xiàng)l例》第一章第四條)
染發(fā)、燙發(fā)、祛斑美白、防曬、防脫發(fā)的化妝品以及宣稱新功效的化妝品為特殊化妝品。
特殊化妝品以外的化妝品為普通化妝品。
香皂不適用本條例,但是宣稱具有特殊化妝品功效的適用本條例。(《化妝品監(jiān)督管理?xiàng)l例》第六章第七十七條)
用于育發(fā)、脫毛、美乳、健美、除臭的化妝品自本條例施行之日起設(shè)置5年過渡期,過渡期內(nèi)可以繼續(xù)生產(chǎn)、進(jìn)口、銷售,過渡期滿后不得生產(chǎn)、進(jìn)口、銷售該化妝品。(《化妝品監(jiān)督管理?xiàng)l例》第六章第七十八條)
化妝品的監(jiān)管部門
中國(guó)化妝品的監(jiān)管部門主要包括以下幾個(gè)主體:
國(guó)家藥品監(jiān)督管理局(NMPA):主要職責(zé)包括制定相關(guān)法規(guī)、政策和標(biāo)準(zhǔn);特殊化妝品上市前審核;化妝品上市后的風(fēng)險(xiǎn)管理;產(chǎn)品抽檢;飛行檢查等。
國(guó)家藥品食品檢定研究院(NIFDC):主要職責(zé)包括制定技術(shù)標(biāo)準(zhǔn)和檢測(cè)方法;承擔(dān)化妝品上市前注冊(cè)的技術(shù)審評(píng)工作等。
地方藥品監(jiān)督管理部門(Local MPAs):主要職責(zé)包括化妝品備案管理(上市前備案);承擔(dān)化妝品生產(chǎn)的行政許可;產(chǎn)品抽檢;開展不良反應(yīng)監(jiān)測(cè)、評(píng)估及處理等。
國(guó)家/地方市場(chǎng)監(jiān)督管理局(State/Local AMR):主要職責(zé)包括綜合市場(chǎng)監(jiān)管與管理;市場(chǎng)主體的統(tǒng)一登記注冊(cè);監(jiān)督和管理市場(chǎng)秩序等。
國(guó)家藥品不良反應(yīng)監(jiān)測(cè)中心(NCADRM):主要職責(zé)包括化妝品不良反應(yīng)監(jiān)測(cè)與上市后安全性評(píng)估;制定相關(guān)技術(shù)標(biāo)準(zhǔn)等。
化妝品在中國(guó)市場(chǎng)上市要求(一般貿(mào)易)
化妝品在中國(guó)市場(chǎng)上市,主要有一般貿(mào)易和線上渠道兩種方式。針對(duì)一般貿(mào)易渠道,監(jiān)管要求和準(zhǔn)入流程具體如下。
1. 化妝品上市流程
化妝品分為特殊化妝品和普通化妝品,特殊化妝品為注冊(cè)管理,普通化妝品為備案管理。不同類別的產(chǎn)品有不同的審批流程。
普通化妝品
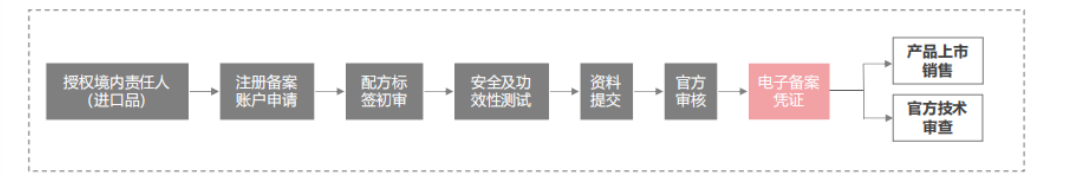
特殊化妝品
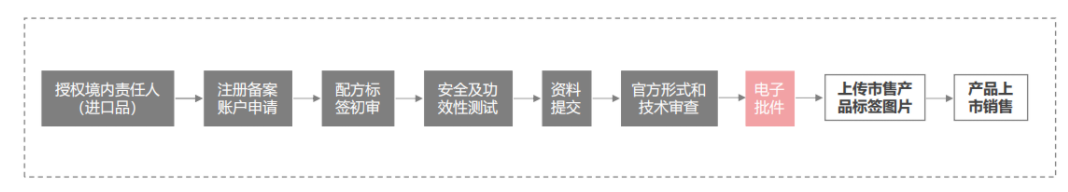
2. 化妝品注冊(cè)人、備案人、境內(nèi)責(zé)任人職責(zé)與資質(zhì)要求
2.1 注冊(cè)人/備案人
注冊(cè)人/備案人:規(guī)定獲得了特殊化妝品注冊(cè)證的注冊(cè)人或通過化妝品備案的備案人,以自己的名義將產(chǎn)品投放市場(chǎng),并對(duì)產(chǎn)品全生命周期質(zhì)量安全和功效宣稱負(fù)責(zé)。
條件:
依法設(shè)立的企業(yè)或者其他組織;
有與申請(qǐng)注冊(cè)、進(jìn)行備案的產(chǎn)品相適應(yīng)的質(zhì)量管理體系;
有化妝品不良反應(yīng)監(jiān)測(cè)與評(píng)價(jià)能力。
化妝品注冊(cè)人、備案人和受托生產(chǎn)企業(yè)應(yīng)當(dāng)設(shè)立質(zhì)量安全負(fù)責(zé)人,該負(fù)責(zé)人應(yīng)具備與化妝品質(zhì)量安全相關(guān)的專業(yè)知識(shí),并具有5年以上化妝品生產(chǎn)或質(zhì)量安全管理經(jīng)驗(yàn)。
2.2 境內(nèi)責(zé)任人
注冊(cè)人、備案人在境外的,應(yīng)當(dāng)指定我國(guó)境內(nèi)的企業(yè)法人作為境內(nèi)責(zé)任人。
義務(wù):
以注冊(cè)人、備案人的名義,辦理化妝品注冊(cè)、備案;
協(xié)助注冊(cè)人、備案人開展化妝品不良反應(yīng)監(jiān)測(cè);
協(xié)助注冊(cè)人、備案人實(shí)施化妝品召回工作;
按照與注冊(cè)人、備案人的協(xié)議,對(duì)投放境內(nèi)市場(chǎng)的化妝品承擔(dān)相應(yīng)的質(zhì)量安全責(zé)任
配合藥品監(jiān)督管理部門的監(jiān)督檢查工作。
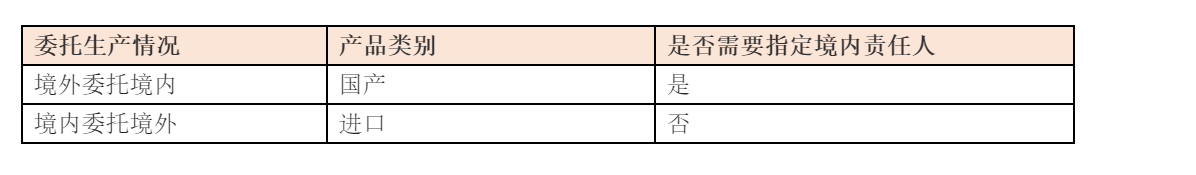
3. 化妝品注冊(cè)備案資料要求
3.1 化妝品注冊(cè)備案資料概覽
根據(jù)《化妝品注冊(cè)備案資料管理規(guī)定》,注冊(cè)人、備案人辦理注冊(cè)或者備案時(shí),應(yīng)當(dāng)提交以下資料:
《化妝品注冊(cè)備案信息表》及相關(guān)資料:產(chǎn)品名稱、企業(yè)信息、分類編碼、已上市證明等
產(chǎn)品名稱信息
產(chǎn)品配方
產(chǎn)品執(zhí)行的標(biāo)準(zhǔn)
產(chǎn)品標(biāo)簽樣稿
產(chǎn)品檢驗(yàn)報(bào)告
產(chǎn)品安全評(píng)估資料
根據(jù)《化妝品監(jiān)督管理?xiàng)l例》(CSAR)及其配套法規(guī)要求,自2022年1月1日起,所有在中國(guó)市場(chǎng)銷售的普通化妝品和特殊化妝品,如果有功效宣稱(如“美白”、“保濕”、“抗皺”等),企業(yè)必須提供功效宣稱依據(jù)摘要,并上傳至國(guó)家藥品監(jiān)督管理局(NMPA)指定的專門網(wǎng)站,供公眾查詢。
3.2 產(chǎn)品配方
產(chǎn)品配方包括原料序號(hào)、原料名稱、百分含量、使用目的、商標(biāo)名、原料生產(chǎn)商及原料安全信息等。要點(diǎn)分析:
原料安全信息:填寫產(chǎn)品所使用原料的生產(chǎn)商信息并上傳由原料生產(chǎn)商出具的原料安全信息文件;或填寫原料報(bào)送碼關(guān)聯(lián)原料安全信息文件。
報(bào)送碼申請(qǐng):主要依據(jù)《化妝品原料安全相關(guān)信息報(bào)送指南》的要求,并通過國(guó)家藥品監(jiān)督管理局原料安全信息服務(wù)平臺(tái)進(jìn)行操作。
3.3 產(chǎn)品執(zhí)行標(biāo)準(zhǔn)
產(chǎn)品執(zhí)行的標(biāo)準(zhǔn)包括產(chǎn)品名稱、全成分、生產(chǎn)工藝、感官指標(biāo)、微生物和理化指標(biāo)及質(zhì)量控制措施、使用方法、貯存條件、使用期限等。
3.4 產(chǎn)品檢驗(yàn)報(bào)告
注冊(cè)或者備案產(chǎn)品的產(chǎn)品檢驗(yàn)報(bào)告,由化妝品注冊(cè)和備案檢驗(yàn)機(jī)構(gòu)出具;依據(jù)為《化妝品安全技術(shù)規(guī)范》、《化妝品注冊(cè)和備案檢驗(yàn)工作規(guī)范》等法規(guī)規(guī)定。
3.4.1 產(chǎn)品檢驗(yàn)報(bào)告包含內(nèi)容
產(chǎn)品檢驗(yàn)報(bào)告包括微生物與理化檢驗(yàn)、毒理學(xué)試驗(yàn)、人體安全性試驗(yàn)報(bào)告和人體功效試驗(yàn)報(bào)告等。
3.4.2 豁免提交毒理學(xué)試驗(yàn)報(bào)告
普通化妝品的生產(chǎn)企業(yè)已取得所在國(guó)(地區(qū))政府主管部門出具的生產(chǎn)質(zhì)量管理體系相關(guān)資質(zhì)認(rèn)證,且產(chǎn)品安全風(fēng)險(xiǎn)評(píng)估結(jié)果能夠充分確認(rèn)產(chǎn)品安全性的,可免于提交該產(chǎn)品的毒理學(xué)試驗(yàn)報(bào)告,有下列情形的除外:
產(chǎn)品宣稱嬰幼兒和兒童使用的;
產(chǎn)品使用尚在安全監(jiān)測(cè)中化妝品新原料的;
根據(jù)量化分級(jí)評(píng)分結(jié)果,備案人、境內(nèi)責(zé)任人、生產(chǎn)企業(yè)被列為重點(diǎn)監(jiān)管對(duì)象的。
有多個(gè)生產(chǎn)企業(yè)生產(chǎn)的,所有生產(chǎn)企業(yè)均已取得所在國(guó)(地區(qū))政府主管部門出具的生產(chǎn)質(zhì)量管理體系相關(guān)資質(zhì)認(rèn)證的,方可免于提交毒理學(xué)試驗(yàn)報(bào)告。
3.5 安全評(píng)估
化妝品注冊(cè)、備案前,注冊(cè)申請(qǐng)人、備案人應(yīng)當(dāng)自行或委托專業(yè)機(jī)構(gòu)開展安全評(píng)估。從事安全評(píng)估的人員應(yīng)當(dāng)具備化妝品質(zhì)量安全相關(guān)專業(yè)知識(shí),并具有5年以上相關(guān)專業(yè)從業(yè)經(jīng)歷。
2025年5月1日起,化妝品注冊(cè)人、備案人申請(qǐng)注冊(cè)或進(jìn)行備案時(shí),需提交符合《化妝品安全評(píng)估技術(shù)導(dǎo)則(2021年版)》等文件的完整版安全評(píng)估資料。
4. 化妝品注冊(cè)備案試驗(yàn)要求
根據(jù)《化妝品監(jiān)督管理?xiàng)l例》和《化妝品注冊(cè)備案資料管理規(guī)定》,化妝品在注冊(cè)或備案時(shí),必須進(jìn)行相應(yīng)的測(cè)試,以確保產(chǎn)品的安全性和功效宣稱的真實(shí)性。
4.1 安全性測(cè)試
根據(jù)《化妝品注冊(cè)和備案檢驗(yàn)工作規(guī)范》,所有注冊(cè)或備案的化妝品都必須進(jìn)行安全性檢測(cè),以確保產(chǎn)品不會(huì)對(duì)人體健康造成危害。
包括:理化指標(biāo)檢測(cè),微生物檢測(cè)、毒理學(xué)測(cè)試(特定情況下的普通化妝品可免于毒理學(xué)測(cè)試)。
4.2 功效評(píng)價(jià)測(cè)試(根據(jù)功效宣稱決定)
根據(jù)《化妝品功效宣稱評(píng)價(jià)規(guī)范》的要求,化妝品企業(yè)在進(jìn)行產(chǎn)品注冊(cè)或備案時(shí),如產(chǎn)品具有特定功效宣稱(如美白、抗皺、保濕、防曬等),需要提供功效宣稱的依據(jù),并在國(guó)家藥監(jiān)局(NMPA)指定的專門網(wǎng)站上傳功效宣稱依據(jù)的摘要,以便公眾查詢和監(jiān)管部門審查。
能夠通過視覺、嗅覺等感官直接識(shí)別的(如清潔、卸妝、美容修飾、芳香、爽身、染發(fā)、燙發(fā)、發(fā)色護(hù)理、脫毛、除臭和輔助剃須剃毛等),或者通過簡(jiǎn)單物理遮蓋、附著、摩擦等方式發(fā)生效果(如物理遮蓋祛斑美白、物理方式去角質(zhì)和物理方式去黑頭等)且在標(biāo)簽上明確標(biāo)識(shí)僅具物理作用的功效宣稱,可免予公布產(chǎn)品功效宣稱依據(jù)的摘要。
根據(jù)具體功效宣稱選擇合適的評(píng)價(jià)依據(jù)
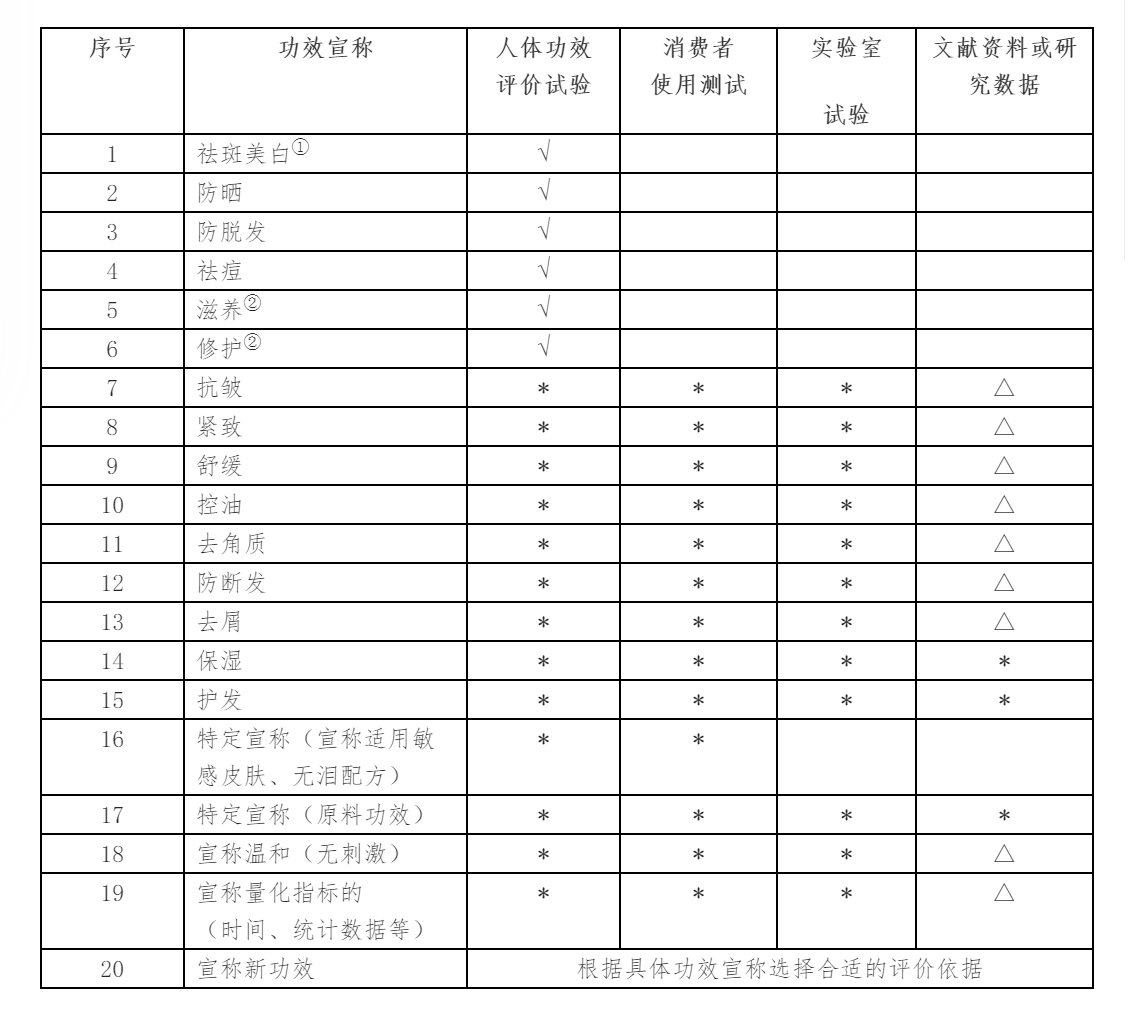
說明:
選項(xiàng)欄中畫√的,為必做項(xiàng)目;
選項(xiàng)欄中畫*的,為可選項(xiàng)目,但必須從中選擇至少一項(xiàng);
選項(xiàng)欄中畫△的,為可搭配項(xiàng)目,但必須配合人體功效評(píng)價(jià)試驗(yàn)、消費(fèi)者使用測(cè)試或者實(shí)驗(yàn)室試驗(yàn)一起使用。
注釋:
① 僅通過物理遮蓋作用發(fā)揮祛斑美白功效,且在標(biāo)簽中明示為物理作用的,可免予提交產(chǎn)品功效宣稱評(píng)價(jià)資料;
② 如功效宣稱作用部位僅為頭發(fā)的,可選擇體外真發(fā)進(jìn)行評(píng)價(jià)。
要點(diǎn)分析:
微生物檢驗(yàn)、理化檢驗(yàn)、毒理學(xué)檢驗(yàn)、人體安全性試驗(yàn)、特殊宣稱(防曬、祛斑美白、防脫發(fā)、新功效)功效實(shí)驗(yàn),需要在中國(guó)化妝品注冊(cè)和備案檢驗(yàn)機(jī)構(gòu)進(jìn)行檢驗(yàn)。
5. 化妝品注冊(cè)備案標(biāo)簽要求
2021年5月31日,國(guó)家藥監(jiān)局發(fā)布實(shí)施《化妝品標(biāo)簽管理辦法》的公告(2021年第77號(hào)),鼓勵(lì)化妝品注冊(cè)人、備案人自本公告發(fā)布之日起,按照《辦法》規(guī)定對(duì)化妝品進(jìn)行標(biāo)簽標(biāo)識(shí)。自2022年5月1日起,申請(qǐng)注冊(cè)或者進(jìn)行備案的化妝品,必須符合《辦法》的規(guī)定和要求;此前申請(qǐng)注冊(cè)或者進(jìn)行備案的化妝品,未按照本《辦法》規(guī)定進(jìn)行標(biāo)簽標(biāo)識(shí)的,化妝品注冊(cè)人、備案人必須在2023年5月1日前完成產(chǎn)品標(biāo)簽的更新,使其符合《辦法》的規(guī)定和要求。
5.1 化妝品標(biāo)簽定義
化妝品標(biāo)簽,是指產(chǎn)品銷售包裝上用以辨識(shí)說明產(chǎn)品基本信息、屬性特征和安全警示等的文字、符號(hào)、數(shù)字、圖案等標(biāo)識(shí),以及附有標(biāo)識(shí)信息的包裝容器、包裝盒和說明書。化妝品注冊(cè)人、備案人對(duì)化妝品標(biāo)簽的合法性、真實(shí)性、完整性、準(zhǔn)確性和一致性負(fù)責(zé)。
注意:化妝品的最小銷售單元應(yīng)當(dāng)有標(biāo)簽。
注意:除文字內(nèi)容外,標(biāo)簽中的符號(hào)、數(shù)字、圖案等標(biāo)識(shí)也屬于化妝品標(biāo)簽上的內(nèi)容,使用其他文字或者符號(hào)的,應(yīng)當(dāng)在產(chǎn)品銷售包裝可視面使用規(guī)范漢字對(duì)應(yīng)解釋說明。
5.2 必須標(biāo)注的內(nèi)容
(一)產(chǎn)品中文名稱、特殊化妝品注冊(cè)證書編號(hào)
(二)注冊(cè)人、備案人的名稱、地址,注冊(cè)人或者備案人為境外企業(yè)的,應(yīng)當(dāng)同時(shí)標(biāo)注境內(nèi)責(zé)任人的名稱、地址
(三)生產(chǎn)企業(yè)的名稱、地址,國(guó)產(chǎn)化妝品應(yīng)當(dāng)同時(shí)標(biāo)注生產(chǎn)企業(yè)生產(chǎn)許可證編號(hào)
(四)產(chǎn)品執(zhí)行的標(biāo)準(zhǔn)編號(hào)
(五)全成分
在銷售包裝可視面標(biāo)注化妝品全部成分的原料標(biāo)準(zhǔn)中文名稱,以“成分”作為引導(dǎo)語引出,并按照各成分在產(chǎn)品配方中含量的降序列出。配方中存在含量不超過0.1%(w/w)的成分的,所有不超過0.1%(w/w)的成分應(yīng)當(dāng)以“其他微量成分”作為引導(dǎo)語引出另行標(biāo)注,可以不按照成分含量的降序列出。
注意:其他微量成分包含原料含量等于0.1%(w/w)的成分。
(六)凈含量
(七)使用期限
形式1:生產(chǎn)日期和保質(zhì)期
形式2:生產(chǎn)批號(hào)和限期使用日期。
① 具有包裝盒的產(chǎn)品,在直接接觸內(nèi)容物的包裝容器上標(biāo)注使用期限時(shí),除可以選擇上述方式標(biāo)注外,還可采用直接標(biāo)注生產(chǎn)批號(hào)和開封后使用期限的方式。
②具有包裝盒的產(chǎn)品,還應(yīng)當(dāng)同時(shí)在直接接觸內(nèi)容物的包裝容器上標(biāo)注產(chǎn)品中文名稱和使用期限。
(八)使用方法
(九)必要的安全警示用語
(十)法律、行政法規(guī)和強(qiáng)制性國(guó)家標(biāo)準(zhǔn)規(guī)定應(yīng)當(dāng)標(biāo)注的其他內(nèi)容。
化妝品加貼中文標(biāo)簽的(如進(jìn)口化妝品上市時(shí)),中文標(biāo)簽有關(guān)產(chǎn)品安全、功效宣稱的內(nèi)容需與原標(biāo)簽相關(guān)內(nèi)容對(duì)應(yīng)一致。即產(chǎn)品在中國(guó)上市時(shí)宣稱的關(guān)于安全、功效的宣稱與在原產(chǎn)國(guó)銷售時(shí)保持一致。
6. 化妝品注冊(cè)備案周期
6.1 化妝品注冊(cè)備案流程
根據(jù)《化妝品注冊(cè)備案管理辦法》,國(guó)家對(duì)特殊化妝品實(shí)行注冊(cè)管理,對(duì)普通化妝品實(shí)行備案管理。
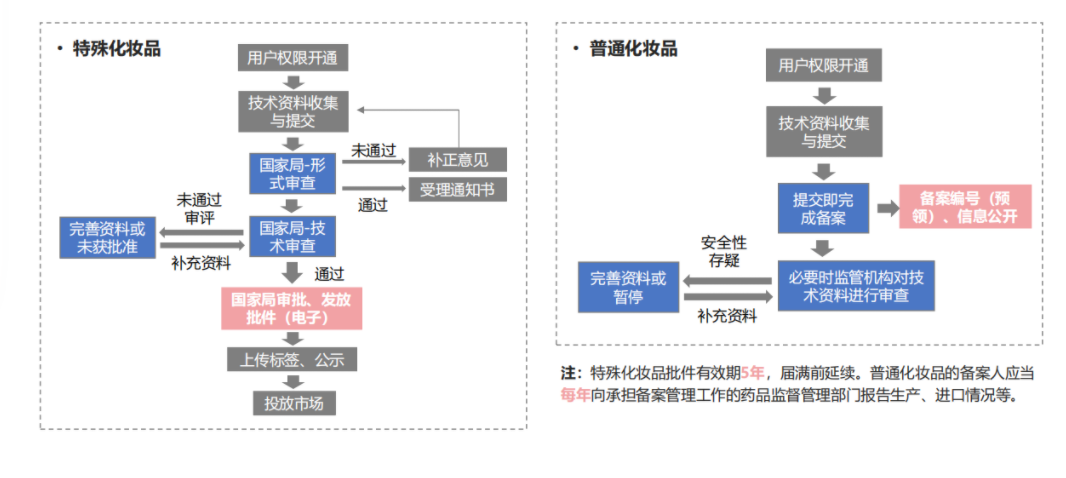
6.2 化妝品注冊(cè)備案周期

*實(shí)際周期根據(jù)具體產(chǎn)品類型、測(cè)試以及多方資料搜集情況有關(guān)。
7. 化妝品注冊(cè)備案變更及延續(xù)
7.1 化妝品注冊(cè)備案變更
根據(jù)《化妝品注冊(cè)備案資料管理規(guī)定》,已注冊(cè)產(chǎn)品的注冊(cè)事項(xiàng)發(fā)生變更的,應(yīng)當(dāng)在擬變更產(chǎn)品生產(chǎn)或者進(jìn)口前提交相應(yīng)資料,完成相應(yīng)的變更之后,方可生產(chǎn)或者進(jìn)口。已備案產(chǎn)品的備案事項(xiàng)發(fā)生變更的,應(yīng)當(dāng)在擬變更產(chǎn)品上市或者進(jìn)口前提交相應(yīng)資料,完成相應(yīng)的變更之后,方可上市或者進(jìn)口。變更前已生產(chǎn)、上市或者進(jìn)口的產(chǎn)品可以銷售至保質(zhì)期結(jié)束。所涉及的變更類型包括:
注冊(cè)人、備案人、境內(nèi)責(zé)任人或者生產(chǎn)企業(yè)的名稱、住所等變更(生產(chǎn)場(chǎng)地未改變)
已注冊(cè)或者備案產(chǎn)品的產(chǎn)品名稱變更
生產(chǎn)場(chǎng)地變更
已注冊(cè)或者備案產(chǎn)品所使用原料的生產(chǎn)商、原料質(zhì)量規(guī)格變更
產(chǎn)品執(zhí)行標(biāo)準(zhǔn)變更
產(chǎn)品標(biāo)簽樣稿變更
產(chǎn)品安全評(píng)估資料內(nèi)容變更
產(chǎn)品分類變更
注冊(cè)人變更
變更境內(nèi)責(zé)任人
涉及其他事項(xiàng)變更的,應(yīng)當(dāng)提交擬變更事項(xiàng)的情況說明,并根據(jù)具體情況提交相關(guān)資料。
7.2 化妝品注冊(cè)備案延續(xù)
根據(jù)《化妝品注冊(cè)備案管理辦法》,特殊化妝品注冊(cè)證有效期屆滿需要延續(xù)的,注冊(cè)人應(yīng)當(dāng)在產(chǎn)品注冊(cè)證有效期屆滿前90個(gè)工作日至30個(gè)工作日期間提出延續(xù)注冊(cè)申請(qǐng),并承諾符合強(qiáng)制性國(guó)家標(biāo)準(zhǔn)、技術(shù)規(guī)范的要求。注冊(cè)人應(yīng)當(dāng)對(duì)提交資料和作出承諾的真實(shí)性、合法性負(fù)責(zé)。逾期未提出延續(xù)注冊(cè)申請(qǐng)的,不再受理其延續(xù)注冊(cè)申請(qǐng)。
根據(jù)《化妝品注冊(cè)備案資料管理規(guī)定》,申請(qǐng)?zhí)厥饣瘖y品注冊(cè)證有效期延續(xù)的,應(yīng)當(dāng)提交以下資料:
注冊(cè)延續(xù)申請(qǐng)表
產(chǎn)品自查情況說明
根據(jù)現(xiàn)行法規(guī)、標(biāo)準(zhǔn)調(diào)整情況,應(yīng)當(dāng)提交相應(yīng)的產(chǎn)品檢驗(yàn)報(bào)告
8. 化妝品上市后監(jiān)管要求
化妝品在完成注冊(cè)或備案并上市銷售后,仍需接受國(guó)家藥品監(jiān)督管理局(NMPA)及地方監(jiān)管部門的持續(xù)監(jiān)管,以確保產(chǎn)品的安全性、功效真實(shí)性及合規(guī)性。
2022年1月1日起,普通化妝品統(tǒng)一實(shí)施年度報(bào)告制度。備案人應(yīng)當(dāng)于每年1月1日至3月31日期間,通過注冊(cè)備案平臺(tái),提交備案時(shí)間滿一年普通化妝品的年度報(bào)告。
8.1 產(chǎn)品質(zhì)量安全監(jiān)管
根據(jù)《化妝品監(jiān)督管理?xiàng)l例》、《化妝品生產(chǎn)經(jīng)營(yíng)監(jiān)督管理辦法》以及《化妝品安全技術(shù)規(guī)范》等,監(jiān)管部門會(huì)定期對(duì)市場(chǎng)上的化妝品進(jìn)行隨機(jī)抽樣檢測(cè),確保產(chǎn)品符合國(guó)家標(biāo)準(zhǔn)。
8.2 不良反應(yīng)監(jiān)測(cè)
根據(jù)《化妝品不良反應(yīng)監(jiān)測(cè)管理辦法》,建立化妝品不良反應(yīng)監(jiān)測(cè)系統(tǒng),收集消費(fèi)者反饋。國(guó)家藥監(jiān)局定期發(fā)布化妝品不良反應(yīng)監(jiān)測(cè)報(bào)告。若某款產(chǎn)品存在嚴(yán)重安全隱患,可能要求企業(yè)召回或停售。化妝品注冊(cè)人、備案人應(yīng)當(dāng)監(jiān)測(cè)其上市銷售化妝品的不良反應(yīng),及時(shí)開展評(píng)價(jià),按照國(guó)務(wù)院藥品監(jiān)督管理部門的規(guī)定向化妝品不良反應(yīng)監(jiān)測(cè)機(jī)構(gòu)報(bào)告。受托生產(chǎn)企業(yè)、化妝品經(jīng)營(yíng)者和醫(yī)療機(jī)構(gòu)發(fā)現(xiàn)可能與使用化妝品有關(guān)的不良反應(yīng)的,應(yīng)當(dāng)報(bào)告化妝品不良反應(yīng)監(jiān)測(cè)機(jī)構(gòu)。
化妝品在中國(guó)市場(chǎng)上市要求(線上渠道)
在中國(guó)市場(chǎng),化妝品也可以通過線上渠道進(jìn)行上市銷售。其中,線上渠道主要包括:國(guó)內(nèi)電商平臺(tái)和跨境電商(CBEC,Cross-Border E-Commerce)。
1. 國(guó)內(nèi)電商平臺(tái)銷售化妝品的監(jiān)管要求
適用于已完成注冊(cè)或備案的國(guó)產(chǎn)或進(jìn)口化妝品,通過國(guó)內(nèi)電商平臺(tái)銷售。電商平臺(tái)需審核商家資質(zhì),確保所售產(chǎn)品已完成注冊(cè)或備案。平臺(tái)需建立投訴舉報(bào)機(jī)制,配合監(jiān)管部門處理違規(guī)商品。同時(shí),產(chǎn)品必須使用中文標(biāo)簽,并符合《化妝品標(biāo)簽管理辦法》,禁止虛假宣傳。
2. 跨境電商(CBEC)銷售化妝品的監(jiān)管要求
適用于未在中國(guó)境內(nèi)注冊(cè)或備案的進(jìn)口化妝品。通過跨境電商零售進(jìn)口模式進(jìn)入中國(guó)市場(chǎng),消費(fèi)者在跨境電商平臺(tái)上下單,商品通過保稅倉(cāng)發(fā)貨或海外直郵方式交付。跨境電商模式通過簡(jiǎn)化備案和檢驗(yàn)流程為海外化妝品提供了快速進(jìn)入中國(guó)市場(chǎng)的路徑,但同時(shí)也受限于正面清單、銷售渠道等。
2.1 化妝品準(zhǔn)入要求
與一般貿(mào)易中所有進(jìn)口的化妝品都需要完成國(guó)家藥監(jiān)局(NMPA)注冊(cè)或備案相比,通過跨境電商進(jìn)口的化妝品無需國(guó)內(nèi)注冊(cè)或備案,但需要符合中國(guó)《跨境電商零售進(jìn)口商品清單》(正面清單)和成分安全要求。
根據(jù)商務(wù)部財(cái)務(wù)司發(fā)布的《關(guān)于完善跨境電子商務(wù)零售進(jìn)口監(jiān)管有關(guān)工作的通知》,跨境電商零售進(jìn)口商品按“個(gè)人自用”監(jiān)管,不執(zhí)行有關(guān)商品首次進(jìn)口許可批件、注冊(cè)或備案要求,但需符合正面清單。
中國(guó)《跨境電商零售進(jìn)口商品清單》(正面清單):僅允許清單內(nèi)化妝品通過跨境電商進(jìn)口。
2.2 標(biāo)簽
產(chǎn)品標(biāo)簽需符合《化妝品監(jiān)督管理?xiàng)l例》《化妝品標(biāo)簽管理辦法》等法規(guī)要求,確保標(biāo)簽信息真實(shí)、完整、規(guī)范。線上銷售的化妝品還需符合《電子商務(wù)法》要求,確保標(biāo)簽信息與備案一致。
2.3 消費(fèi)者“個(gè)人自用”限制
通過跨境電商購(gòu)買的化妝品僅限個(gè)人使用,不得用于二次銷售。購(gòu)買人需進(jìn)行實(shí)名認(rèn)證,并符合跨境電商年度購(gòu)買額度(26,000元人民幣/人)。
我們的服務(wù)
中國(guó)化妝品注冊(cè)備案
中國(guó)化妝品新原料注冊(cè)備案
中國(guó)化妝品原料安全信息報(bào)送碼申請(qǐng)
中國(guó)化妝品安全與功效檢測(cè)
毒理安全評(píng)估
配方/標(biāo)簽/原料審核
境內(nèi)責(zé)任人
上述信息,涵蓋圖片、視頻以及各類文字資料,美天彩僅扮演信息存儲(chǔ)的角色。若存在任何侵犯知識(shí)產(chǎn)權(quán)或其他合法權(quán)益的情形,請(qǐng)立即聯(lián)系我們刪除,切實(shí)維護(hù)您的權(quán)益。
鄭重聲明
- 延伸閱讀:
- 上一篇:化妝品安全風(fēng)險(xiǎn)監(jiān)測(cè)與評(píng)價(jià)標(biāo)準(zhǔn)規(guī)定解讀
- 下一篇:中國(guó)化妝品新原料注冊(cè)備案指南

Experts Q & A
外貿(mào)專家答疑
為了幫助您更快地解決問題,建議向我們的外貿(mào)專家進(jìn)行咨詢,提供專業(yè)的方案咨詢和策劃。


馬上留言 (0) 0